Батериите са най-често срещаният източник на захранване за основни преносими устройства за широкомащабни индустриални приложения. Батерията може да бъде определена, тъй като е комбинация от една или повече електрохимични клетки, които са способни да преобразуват съхранената химическа енергия в електрическа енергия.

Работа на батерията:
Батерията е устройство, което се състои от различни волтаични клетки. Всяка волтаична клетка се състои от две половин клетки, свързани последователно от проводящ електролит, задържащ аниони и котешки йони. Едната полуклетка включва електролит и електрода, към който се движат анионите, т.е. анодът или отрицателният електрод, а другата полуклетка включва електролит и електрода, към който се движат котешките йони, т.е. катод или положителен електрод.
При окислително-редукционната реакция, която захранва батерията, се получава редукция до катиони на катода, докато окислението се получава до аниони в анода. Електродите не се допират един до друг, но са електрически свързани от електролита. Предимно половините клетки имат различни електролити. Всичко, което се счита за всяка полуклетка, е затворено в контейнер и сепаратор, който е порест за йони, но не и по-голямата част от електролитите предотвратяват смесването.

Работа на батерията
Всяка половин клетка има електродвижеща сила (Emf), определена от нейната способност да задвижва електрически ток от вътрешността към външността на клетката. Нето emf на клетката е разликата между emf на нейните полуклетки. По този начин, ако електродите имат emf и с други думи, нетната emf е разликата между редукционните потенциали на полуреакциите.
Как да поддържам батерията?
За да поддържате батерията в добро състояние, е необходимо изравняване на батерията. Поради стареенето всички клетки не се зареждат по подобен начин и някои клетки приемат заряд изключително бързо, докато други се зареждат постепенно. Изравняването може да се извърши чрез незначително презареждане на батерията, за да се позволи и на по-слабите клетки да се заредят напълно. Клемното напрежение на напълно заредена батерия е 12V, автомобилната батерия показва 13,8V в клемите си, докато 12-волтовата тръбна батерия ще показва 14,8V. Автомобилната батерия трябва да бъде здраво закрепена в автомобила, за да се избегне разклащане. Инверторната батерия трябва да се постави върху дървена дъска, ако е възможно.
2 вида батерии
1) Основни батерии:
Както подсказва името, тези батерии са предназначени за еднократна употреба. След като се използват тези батерии, те не могат да се презареждат, тъй като устройствата не са лесно реверсируеми и активните материали може да не се върнат в първоначалните си форми. Производителите на батерии препоръчват срещу презареждане на първични клетки.
Някои от примерите за батериите за еднократна употреба са обикновените батерии AA, AAA, които използваме в стенни часовници, телевизионни дистанционни и др. Другото име на тези батерии са батериите за еднократна употреба.

Видове батерия
2) Вторични батерии:
Вторичните батерии също се наричат акумулаторни батерии. Тези батерии могат да се използват и зареждат едновременно. Обикновено се сглобяват с активни материали с активни в разредено състояние. Акумулаторните батерии се презареждат чрез прилагане на електрически ток, който обръща химичните реакции, които възникват по време на разреждането. Зарядните устройства са устройства, които подават необходимия ток.
Някои примери за тези акумулаторни батерии са батериите, използвани в мобилни телефони, MP3 плейъри и др. Устройства като слухови апарати и ръчни часовници използват миниатюрни клетки и на места като телефонни централи или компютърни центрове за данни се използват по-големи батерии.

Вторични батерии
Видове вторични (акумулаторни) батерии:
SMF, оловна киселина, Li и Nicd
SMF батерия:
SMF е a запечатана батерия без поддръжка, проектирана да предлага надеждна, последователна и ниска мощност за поддръжка за UPS приложения. Тези батерии могат да бъдат обект на приложения с дълбок цикъл и минимална поддръжка в селските райони и районите с дефицит на енергия. Тези батерии се предлагат от 12V.
В съвременния информативен свят не може да се пренебрегне изискването батерийните системи да са проектирани да възстановяват важни квалифицирани данни и информация и да изпълняват основни инструменти за желаната продължителност. Батериите са необходими, за да доставят незабавна мощност. Ненадеждните и лоши батерии могат да доведат до загуба на данни и изключване на оборудването, което може да струва на компаниите значителни финансови загуби. Впоследствие UPS сегментите призовават за използването на надеждна и доказана батерийна система.

SMF батерия
Литиева (Li) батерия:
Всички го използваме в преносими устройства като мобилен телефон, преносим компютър или електроинструмент. Литиевата батерия е едно от най-големите постижения в преносимото захранване през последното десетилетие с използването на литиеви батерии успяхме да преминем от черно-бели мобилни към цветни мобилни телефони с допълнителни функции като GPS, предупреждения по имейл и т.н. Това са високите устройства с потенциал за енергийна плътност за по-голям капацитет. И относително ниски саморазрядни батерии. Също така Специалните клетки могат да осигурят много висок ток на приложения като електроинструменти.

Li батерия
Никел-кадмиева (Nicd) батерия:
Никел-кадмиевите батерии имат предимството да бъдат презареждани многократно и притежават относително постоянен потенциал по време на разреждане и имат по-голяма електрическа и физическа издръжливост. Тази батерия използва никелов оксид за катод, кадмиево съединение за анод и разтвор на калиев хидроксид като свой електролит.

Когато батерията се зареди, химичният състав на катода се трансформира и никеловият хидроксид се променя на NIOOH. В анода образуването на кадмиеви йони се извършва от кадмиев хидроксид. Когато батерията се изтощи, кадмият реагира с NiOOH, образувайки обратно никелов хидроксид и кадмиев хидроксид.
Cd + 2H2O + 2NiOOH -> 2Ni (OH) 2 + Cd (OH) 2
Оловно-киселинна батерия:
Оловно-киселинните батерии се използват широко в автомобилите, инверторите, резервните захранващи системи и др. За разлика от тръбните и необслужваеми батерии, оловно-киселинните батерии изискват подходящи грижи и поддръжка, за да удължат живота си. Оловно-киселинната батерия се състои от поредица от плочи, държани потопени в разтвор на сярна киселина. Плочите имат решетки, върху които е прикрепен активният материал. Плочите са разделени на положителни и отрицателни плочи. Положителните плочи държат чист олово като активен материал, докато оловният оксид е прикрепен към отрицателните плочи.

Оловно-киселинна батерия
Напълно заредената батерия може да разреди тока си, когато е свързана към товар. По време на процеса на изхвърляне сярната киселина се комбинира с активните материали върху положителните и отрицателните плочи, което води до образуването на оловен сулфат. Водата е най-важната стъпка за поддържане на оловно-киселинна батерия. Честотата на водата зависи от употребата, метода на зареждане и работната температура. По време на процеса водородните атоми от сярната киселина реагират с кислород, образувайки вода.
Това води до освобождаване на електрони от положителните плочи, които ще бъдат приети от отрицателните плочи. Това води до образуване на електрически потенциал в батерията. Електролитът в оловната батерия е смес от сярна киселина и вода, която има специфично тегло. Специфичното тегло е теглото на киселинно-водната смес в сравнение с еднакъв обем вода. Специфичното тегло на чистата вода без йони е 1.
Оловно-киселинните батерии осигуряват най-добрата стойност за мощност и енергия за киловатчас имат най-дългия жизнен цикъл и голямо екологично предимство, тъй като се рециклират с изключително висока скорост. Никоя друга химия не може да се докосне до съществуващата инфраструктура за събиране, транспортиране и рециклиране на оловно-киселинни батерии.
Заедно с тази статия се обсъжда литиево-йонната батерия с нейните предимства и недостатъци.
Работа на литиево-йонна батерия

Литиево-йонните батерии сега са популярни в повечето електронни преносими устройства като мобилен телефон, лаптоп, цифров фотоапарат и др. Поради тяхната дълготрайна енергийна ефективност. Това са най-популярните акумулаторни батерии с предимства като най-добра енергийна плътност, незначителна загуба на заряд и липса на ефект на паметта. Li-Ion батерията използва литиеви йони като носители на заряд, които се придвижват от отрицателния електрод към положителния електрод по време на разреждане и обратно при зареждане. По време на зареждането външният ток от зарядното устройство подава свръхнапрежение от това в батерията. Това принуждава тока да премине в обратна посока от положителния към отрицателния електрод, където литиевите йони се вграждат в порьозния електроден материал чрез процес, наречен Intercalation. Литиевите йони преминават през неводния електролит и мембраната на сепаратора. Електродният материал е интеркалирано литиево съединение.
Отрицателният електрод на Li-Ion батерията е изграден от въглерод, а положителният електрод е метален оксид. Най-често използваният материал в отрицателния електрод е графитът, докато в положителния електрод може да бъде литиев кобалтов оксид, литиево-йонни фосфати или литиево-манганов оксид. Като електролит се използва литиева сол в органичен разтворител. Електролитът обикновено е смес от органични карбонати като етилен карбонат или диетилов карбонат, съдържащи литиеви йони. Електролитът използва анионни соли като литиев хекса флуоро фосфат, литиев хекса флуоро арсенат монохидрат, литий на хлорат, литиев хекса флуорорат и др. В зависимост от използваната сол, напрежението, капацитетът и живота на батерията варират. Чистият литий реагира енергично с вода, образувайки литиев хидроксид и водородни йони. Така че използваният електролит е неводен органичен разтворител. Електрохимичната роля на заряда на електродите между анода и катода зависи от посоката на протичане на тока.

Реакция на литиево-йонна батерия
В Li-Ion батерията и двата електрода могат да приемат и освобождават литиеви йони. По време на процеса на интеркалация литиевите йони се преместват в електрода. По време на обратния процес, наречен де интеркалация, литиевите йони се движат обратно. По време на разреждането положителните литиеви йони ще бъдат извлечени от отрицателните електроди и вкарани в положителния електрод. По време на процеса на зареждане се извършва обратното движение на литиеви йони.
Предимства на литиево-йонната батерия:
Литиево-йонните батерии превъзхождат NiCd батериите и другите вторични батерии. Някои от предимствата са
- Леко тегло в сравнение с други батерии с подобен размер
- Предлага се в различна форма, включително плоска форма
- Високо напрежение в отворена верига, което увеличава трансфера на мощност при нисък ток
- Липса на ефект на паметта.
- Много ниска степен на саморазряд от 5-10% на месец. Саморазрядът е около 30% в NiCd и NiMh батериите.
- Екологична батерия без никакъв свободен литиев метал
Но заедно с предимствата, подобно на другите батерии, Li-Ion батерията страда и от някои недостатъци.
Недостатъци на литиево-йонната батерия:
- Отлаганията вътре в електролита с течение на времето ще възпрепятстват потока на заряда. Това увеличава вътрешното съпротивление на батерията и способността на клетката да подава ток постепенно намалява.
- Високото зареждане и високата температура могат да доведат до загуба на капацитет
- Когато се прегрее, Li-Ion батерията може да претърпи изтичане на топлина и руптура на клетката.
- Дълбокото разреждане може да доведе до късо съединение на Li-Ion батерията. Така че, за да се предотврати това, някои производители имат вътрешна изключена верига, която изключва батерията, когато напрежението й е над безопасното ниво от 3 до 4,2 волта. В този случай, когато батерията не се използва дълго време, вътрешната схема ще консумира енергия и ще изтощи батерията под изключеното напрежение. Така че за зареждане на такива батерии нормалните зарядни устройства не са полезни.


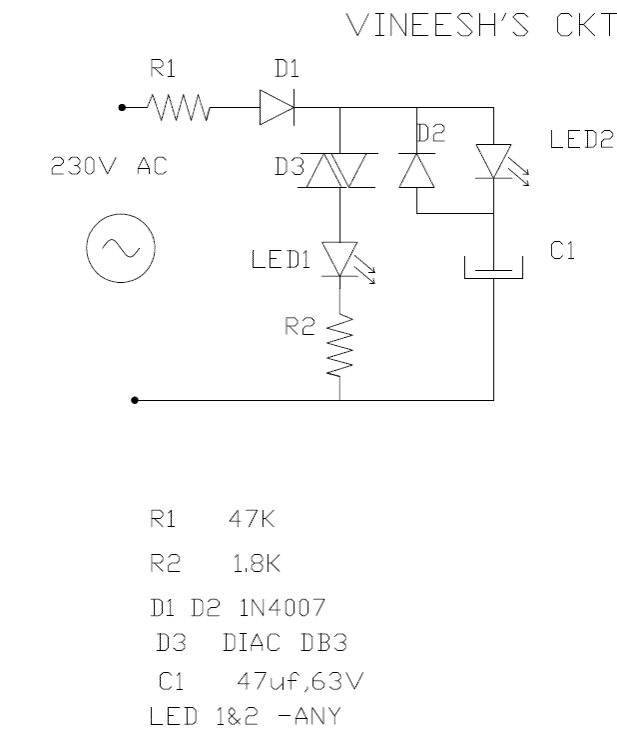
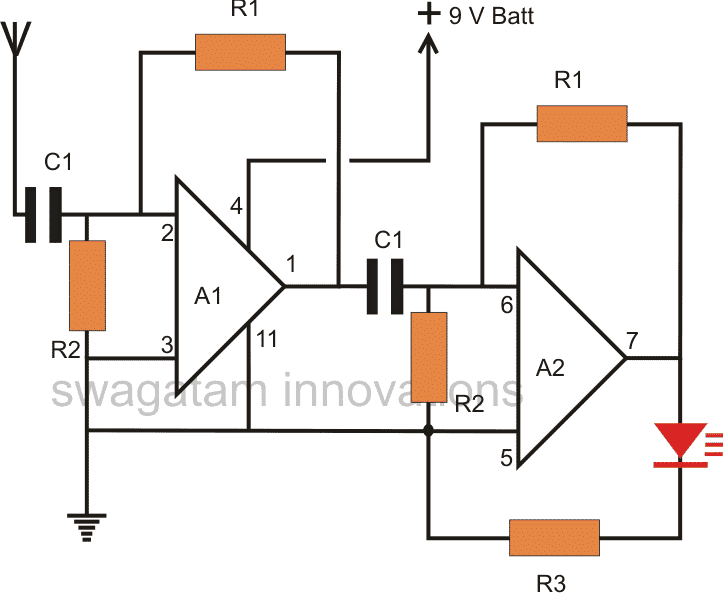
![Контролни светлини, вентилатор, с помощта на дистанционното управление на телевизора [Пълна електрическа схема]](https://electronics.jf-parede.pt/img/3-phase-power/43/control-lights-fan-using-tv-remote-full-circuit-diagram-1.jpg)